Grâce à une analyse en dichroïsme circulaire menée sur la plateforme Biophysique et Biologie Structurale (B2S), la stabilité structurale de peptoïdes sous forme all-cis Polyproline I a été démontrée et des conditions nouvelles de synthèse organique ont été mises au point.
La synthèse de structures secondaires hélicoïdales biomimétiques est très recherchée pour la construction de nanomatériaux innovants avec des applications médicales possibles telles que le développement de modulateurs d'interactions protéine-protéine.
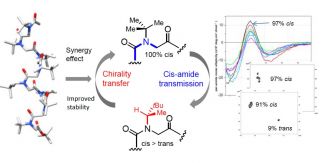
Les peptoïdes, une famille d'oligomères peptidomimétiques, ont une propension à se structurer en hélice. Cependant, l'isomérisation cis-trans du squelette tertiaire peut nuire à l'adoption par le peptoïde de structures secondaires stables, notamment la conformation hélicoïdale all-cis Polyproline I.
En couplant des méthodes d'analyses en dichroïsme circulaire et RMN, l'étude a montré que les monomères NtBu, positionnés stratégiquement dans les séquences chirales, peuvent renforcer et stabiliser le degré d'hélicité des peptoïdes même avec un contenu réduit de chaînes latérales chirales.
Publication associée : Rzeigui M, Traikia M, Jouffret L, Kriznik A, Khiari J, Roy O, Taillefumier C. Strengthening Peptoid Helicity through Sequence Site-Specific Positioning of Amide Cis-Inducing NtBu monomers. J Org Chem. 2019 Dec 24.
DOI : 10.1021/acs.joc.9b02916
PMID : 31873018
HAL : HAL-02430577