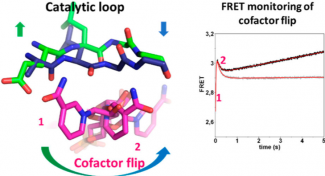
En combinant des approches biophysiques (disponibles sur la plateforme B2S), cinétiques, d’ingénierie protéique, et de dynamique moléculaire ciblée (en collaboration avec le groupe d’I. André, LISBP CNRS-INRA-INSA Toulouse), l’équipe Enzymologie Moléculaire et Structurale du laboratoire IMoPA (CNRS-Université de Lorraine) a pu identifier au cœur d’une enzyme, un élément moléculaire clé à l’origine de mouvements structuraux très localisés mais cruciaux pour l’efficacité enzymatique des Aldéhyde déshydrogénases.
Ces enzymes jouent des rôles déterminants dans la détoxication de composés comme certains polluants (fumée de cigarette…) ou l’alcool, mais également dans la biosynthèse de métabolites essentiels, par exemple dans le métabolisme de la vitamine A.
Publication associée : Rahuel-Clermont S, Bchini R, Barbe S, Boutserin S, André I, Talfournier F. Enzyme Active Site Loop Revealed as a Gatekeeper for Cofactor Flip by Targeted Molecular Dynamics Simulations and FRET-Based Kinetics. ACS Catal. 2019 ; 9 ; 1337−1346.
DOI : 10.1021/acscatal.8b03951
HAL : HAL-02022828