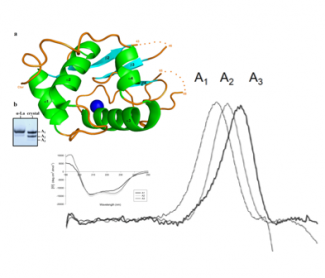
Grâce aux ressources de la plateforme B2S (diffraction RX, dichroïsme circulaire et microcalorimétrie), des chercheurs de l’université de Tizi-Ouzou, Algérie (S. Si Ahmed Zennia & A. Mati) en collaboration avec deux laboratoires de l’Université de Lorraine (URAFPA ENSAIA, J-M. Girardet & C. Cakir-Kiefer ; et IMoPA, C. Charron & A. Kriznik), ont mis en évidence une augmentation de la stabilité thermique et de la résistance à la protéolyse de l’⍺-lactalbumine désamidée, ainsi que la formation d'une hélice ⍺ surnuméraire.
Ces travaux publiés dans Food Chemistry illustrent la façon dont les protéines essentielles de ces animaux du désert ont évoluées afin de résister aux fortes températures rencontrées sous ces latitudes.
Publication associée : S.Si Ahmed Zennia, A.Mati, C.Charron, C.Cakir-Kiefer, A.Kriznik, J-M.Girardet. Effect of nonenzymatic deamidation on the structure stability of Camelus dromedarius alpha-lactalbumin.Food Chemistry. 2019 Avril 8
HAL : HAL-02095313