L’expertise de l’UMS2008/US40 IBSLor et de l'UMR7365 IMoPA en cinétiques rapides (dichroïsme circulaire et fluorescence) a permis de mesurer au niveau moléculaire la vitesse d’un changement conformationnel déterminant pour la régulation d’une enzyme antioxydante, la Peroxyrédoxine.
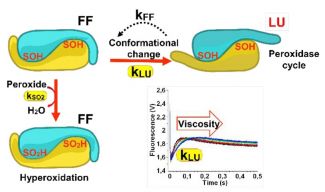
La biologie redox est un domaine de recherches dont l’objectif est de comprendre la régulation de processus majeurs comme le vieillissement et les maladies associées par des espèces réactives oxydantes comme les peroxydes. Les peroxyrédoxines (Prx) sont des enzymes antioxydantes majeures qui détoxifient les peroxydes. Elles sont régulées par oxydation au niveau de fonctions thiol, notamment par sulfinylation, une modification dont l’impact majeur dans les cellules humaines a été démontré récemment. La sensibilité à la sulfinylation dépend au niveau moléculaire d’un mouvement de la structure protéique inhérent au cycle catalytique de l’enzyme lors de sa réaction avec un peroxyde.
L'analyse de la réaction d’une Peroxyrédoxine par des outils de cinétiques rapides en mode fluorescence et dichroïsme circulaire a montré que la sensibilité à la sulfinylation dépend strictement de la compétition entre le processus de sulfinylation et cette bascule moléculaire. À partir de leurs paramètres cinétiques, il est possible de prédire la sensibilité relative des Prx à la suroxydation avec différents substrats, in vitro et in vivo. Ce travail établit les bases de la compréhension de la régulation de protéines redox par sulfinylation, un processus majeur en cas de déséquilibre redox physiologique ou pathologique.
Publication associée : Kriznik A, Libiad M, Le Cordier H, Boukhenouna S, Toledano MB, Rahuel-Clermont S. Dynamics of a key conformational transition in the mechanism of peroxiredoxin sulfinylation. ACS Catalysis. 2020.
HAL:HAL-02473398